Растворы твердых лекарственных веществ
Большинство твердых лекарственных веществ являются кристаллическими веществами. Процесс растворения кристаллического вещества состоит из двух одновременно протекающих процессов: сольватации (в данном случае гидратации) частиц и разрушения кристаллической решетки.
На рис.15G показан процесс растворения натрия хлорида (кристаллическое ионное соединение) в воде (полярная жидкость). Ионы натрия хлорида взаимодействуют с дипольными молекулами воды: к положительному иону Na+ диполи обращены своими отрицательными полюсами, а к отрицательным ионам С1 - положительными. Постепенно диполи воды проникают между нонами Na+ и С1 - в твердой фазе, отрывая их от кристалла.
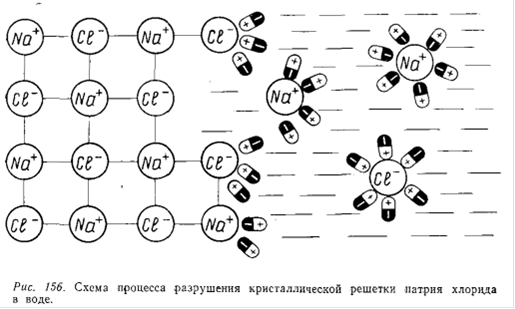
Для эффективности растворения важно, чтобы силы сцепления между молекулами растворителя и частицами растворяемого вещества были больше сил взаимного притяжения этих частиц между собой. Вода по сравнению с другими растворителями обладает огромной полярностью (самое высокое значение диэлектрической постоянной). Именно этим свойством обусловливаются высокая ионизирующая способность воды и ее разрушительное действие на кристаллические решетки многих полярных соединений.
При растворении веществ наблюдается поглощение или выделение теплоты. Поглощение теплоты указывает на затрату энергии. Объясняется это тем, что на перевод вещества из твердого состояния в жидкое, т.е. на разрушение кристаллической решетки, обязательно расходуется энергия. Например, ионы натрия и хло. ра до растворения натрия хлорида в воде фиксированы в узлах кристаллической решетки, обладая при этом только вращательными и колебательными движениями. После же растворения ионы получают возможность относительно свободно двигаться внутри раствора, для чего необходимо увеличение их кинетической энергии. Увеличение ее происходит за счет отнятия энергии у растворителя в форме тепла, в результате чего происходит охлаждение раствора. Чем прочнее кристаллическая решетка, тем значительнее охлаждение раствора.
Выделение тепла при растворении веществ всегда указывает на активно протекающую сольватацию, т.е. образование соединений между растворимым веществом и растворителем.
Конечный тепловой эффект растворения (Q) нужно рассматривать как сумму двух слагаемых - положительного теплового эффекта сольватации (q) и отрицательного теплового эффекта разрушения кристаллической решетки (-с):
= q + ( - с).
Знак теплового эффекта растворения будет зависеть от того, какое слагаемое преобладает. Если кристаллическая решетка прочна, то слагаемое (-с) численно больше q;. в этом случае растворение вещества будет проходить с поглощением тепла. Наоборот, у веществ с непрочной кристаллической решеткой и сильно сольватируемых (гидратируе-мых) превалирует слагаемое q; при этом растворение будет проходить с выделением тепла. Часто положительный и отрицательный тепловые эффекты растворения оказываются одинаковыми или очень близкими друг к Другу; в таких случаях при растворении мы не замечаем охлаждения или разогревания раствора.
Тепловой эффект растворения относят к 1 молю вещества, растворяемому в достаточно большом количестве растворителя. С поглощением тепла растворяются KN03 [Q=-8,52 ккал/ (г-моль)], Ki (-5,11), NaCl (-1,2),. NaBr (-0, 19) и многие другие кристаллические вещества. С выделением тепла растворяются AgN03 [Q=+5,4 ккал/ (г-моль)], NaOH (+10,0) и некоторые другие вещества. При растворении 'Кристаллогидратов в воде наблюдается более низкий тепловой эффект, чем при растворении безводной соли. Например, теплота растворения безводно-то СаС12 равна +17,41 ккал/{г-моль), а СаС126Н20 составляет - 4,31 ккал/ (г-моль). Разница (+ 17,41) - (-4,31) =21,72 ккал представляет собой теплоту образования кристаллогидрата.
